Forschungsteam entschlüsselt dynamische Regulation von Zellbewegungen
- Forschung
- Top-Meldungen
- Medieninformationen

Einzelne Körperzellen erzeugen sehr dynamische Kontraktionen, wodurch sie ständig ihre Form ändern und in Bewegung sind. So können beispielsweise weiße Blutkörperchen an der Innenseite der Blutgefäße entlangwandern und von dort durch winzige Zwischenräume zu Entzündungsherden gelangen, um diese zu bekämpfen. Ähnlich verhält es sich mit Krebszellen, die in fremdes Gewebe eindringen und dort Metastasen bilden. Ein besseres Verständnis dafür, wie sich Zellen bewegen und wie sich ihre Signalnetzwerke unter bestimmten Bedingungen verhalten, kann dabei helfen, die Ausbreitung von Krebszellen oder Fehlbildungen bei Embryonen besser nachzuvollziehen und neue, zielgerichtete Therapien zu entwickeln.
Um das Signalnetzwerk, das die Zellkontraktion steuert, zu untersuchen, hat Dehmelts Gruppe gezielt spezielle Moleküle, deren Funktion mit blauem Licht gesteuert werden kann, in lebende Zellen eingebracht. Mithilfe dieser Lichtkontrolle konnte sie unter dem Mikroskop Veränderungen der Netzwerkdynamik in den Zellen beobachten und messen. Aus dieser optogenetischen Untersuchung konnte sie Rückschlüsse auf die Signalverarbeitung ziehen: Ein zentraler Aspekt sind insbesondere positive und negative Rückkopplungsschleifen im Netzwerk, welche dynamische Signalpulse erzeugen.
Durch die lichtbasierte Manipulation konnte die Konzentration des Aktivatorproteins GEF-H1 in der Zelle präzise eingestellt werden. Dieses aktiviert das Signalprotein Rho, das wiederum die Aktivität von GEF-H1 erhöht. So entsteht eine positive Rückkopplung, durch die sich beide Proteine wechselseitig verstärken. In einem parallelen, langsameren Prozess aktiviert Rho auch das Motorprotein Myosin. Dieses Protein spielt eine wichtige Rolle in der Muskelbewegung und sorgt auch in anderen Zellen für Kontraktionen. Gleichzeitig hemmt Myosin wiederum GEF-H1, das den Prozess ursprünglich in Gang gebracht hat. Hierdurch entsteht zeitverzögert auch eine negative Rückkopplung, durch die GEF-H1 wieder inaktiviert wird. Durch die Kombination der positiven und der zeitverzögerten negativen Rückkopplungsschleife kann das Signalnetzwerk Kontraktionspulse generieren.
Erkenntnisse für die Embryonalentwicklung und das Krebswachstum
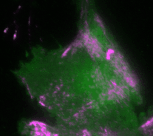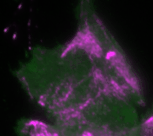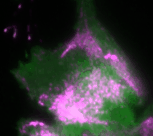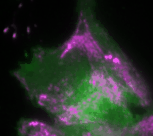
„Basierend auf diesen Ergebnissen haben wir ein theoretisches Modell erstellt, das die Interaktionen des Signalnetzwerks quantitativ beschreibt. Anhand des Modells konnten wir vorhersagen, wie sich die Dynamik des Netzwerks durch gezielte Störungen der Rückkopplungsschleifen verändert“, erklärt Dr. Dehmelt. Ihre Vorhersagen konnten die Forscherinnen und Forscher anschließend durch ihre optogenetischen Untersuchungen bestätigen: So erzeugt das Signalprotein Rho bei einer mittleren Konzentration des Aktivatorproteins GEF-H1 besonders intensive Pulse. Ein solcher Zellzustand, bei dem besonders intensive und regelmäßige Kontraktionspulse generiert werden, spielt insbesondere in der Embryonalentwicklung eine wichtige Rolle.
Bei einer niedrigen GEF-H1-Konzentration ist das Signalnetzwerk dagegen besonders sensitiv, das heißt, es kann mechanische und biochemische Signale besonders gut verarbeiten. Dieser Prozess, der als Mechanotransduktion bezeichnet wird, spielt zum Beispiel eine wichtige Rolle im Krebswachstum.
Die theoretischen und experimentellen Ergebnisse der Gruppe von Dr. Leif Dehmelt bilden damit neue, grundlegende Erkenntnisse, um die komplexen Prozesse in der Embryonalentwicklung und im Krebswachstum besser zu verstehen. Sie wurden Anfang Dezember in der renommierten Fachzeitschrift Cell Reports veröffentlicht.
Publikation:
Kamps et al., Optogenetic Tuning Reveals Rho Amplification-Dependent Dynamics of a Cell Contraction Signal Network. Cell Reports 33:108467 (2020)
DOI: 10.1016/j.celrep.2020.108467
Ansprechpartner bei Rückfragen: