Neue Erkenntnisse zur Funktionsweise von Enzymen
- Research
- Top News
- Press Releases
- Top-Meldungen
- Forschung
- Medieninformationen

Prof. Rasmus Linser forscht an der TU Dortmund schwerpunktmäßig zu Methoden, mit denen man Proteine und ihre Beweglichkeit untersuchen kann. Jetzt haben er und sein Team gemeinsam mit Kollegen von der Ruhr-Universität Bochum und der Ludwig-Maximilians-Universität München mithilfe dieser Methoden neue Erkenntnisse über ein Protein erzielt, das schon seit vielen Jahren im Fokus der pharmakologischen Forschung steht. Das Enzym hCAII, die humane Carboanhydrase, kommt beinahe überall im Körper vor. Es sorgt als Katalysator dafür, dass Kohlenstoffdioxid und Wasser sich zu Kohlensäure verbinden – und umgekehrt. Diese Reaktion läuft in einer eigens dafür vorgesehenen Tasche des Enzyms ab, die auch „aktives Zentrum“ genannt wird.
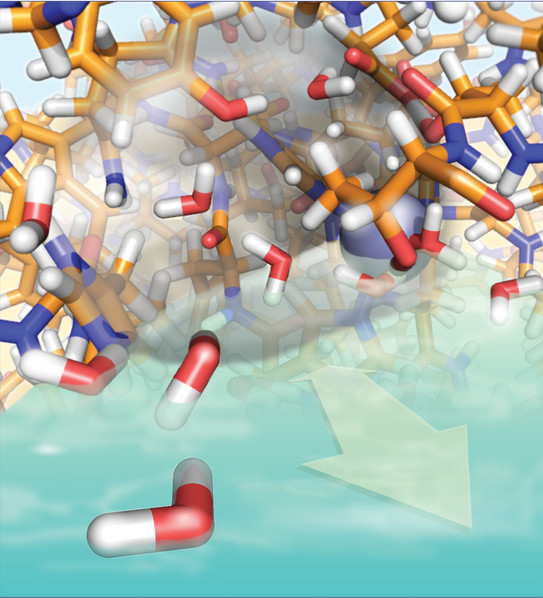
Was genau in diesem Zentrum passiert, haben die Forscher mit der sogenannten Festkörper-NMR-Spektroskopie untersucht. Prof. Rasmus Linser ist Spezialist für diese Methode, deren Besonderheit darin besteht, dass sie Informationen über Vorgänge auf einer ganz bestimmten Zeitskala liefern kann – nämlich im Mikro- bis Millisekunden-Bereich. „Es gibt unterschiedliche Zeitskalen, die für die Erforschung von Proteinen spannend sind“, sagt Linser. „Ganz schnelle Bewegungen lassen sich zum Beispiel mit herkömmlicher NMR-Spektroskopie gut untersuchen. Langsame Bewegungen kann man über Echtzeitexperimente nachvollziehen. Im Mikro- bis Millisekunden-Bereich ist es aber besonders schwer, Informationen zu bekommen.“ Diese Zeitskala ist aber von besonderer Wichtigkeit für die Funktionalität von Proteinen als Enzyme sowie ihre Rolle in der Kommunikation innerhalb der Zelle. Aus diesem Grund hat Linser in den vergangenen Jahren die Festkörper-NMR-Spektroskopie weiterentwickelt. Die Methode untersucht Proteine in fester Phase und ist besonders gut für größere Strukturen geeignet.
Forschende beobachten erstmals Bewegung im aktiven Zentrum des Enzyms
Das in der aktuellen Arbeit untersuchte Enzym wurde bislang hauptsächlich mit kristallographischen Methoden erforscht, die Temperaturen von minus 200 Grad erfordern. Das führte dazu, dass Bewegungen, die bei normaler Körpertemperatur stattfinden, nicht erkennbar waren. Deshalb haben sich Wissenschaftlerinnen und Wissenschaftler das Enzym bislang als steifes, nicht flexibles Konstrukt vorgestellt. „Wir konnten nun erstmals beobachten, dass tatsächlich auf der von uns untersuchten Zeitskala, auf der auch die wichtige enzymatische Katalyse dieses Enzyms stattfindet, deutliche Bewegung im aktiven Zentrum existiert“, berichtet Linser.
Das Team konnte zeigen, dass sich nicht nur das aktive Zentrum des Enzyms auf der Mikrosekundenzeitskala bewegt, sondern auch das Wassernetzwerk, welches darin sitzt. Das Spannende dabei: Die Wassermoleküle besetzen immer wieder ganz bestimmte Stellen in der Tasche. Die einzelnen Wassermoleküle bleiben allerdings nicht lange auf ihren vorgegebenen Plätzen, sondern werden bereits nach Nanosekunden, also nach einer Zeit noch viel kürzer als Mikrosekunden, wieder ausgetauscht. Das könne man sich vorstellen wie bei einem Bus, in dem ständig neue Menschen sitzen – jedoch immer auf den durch die jeweilige Architektur des Innenraumes vorgegebenen Plätzen, so Linser.
Erkenntnisse auch wichtig für Exzellenzcluster Resolv
Obwohl die einzelnen Wassermoleküle kaum verweilen, zeigen sich auch auf der Mikrosekundenzeitskala Veränderungen in der Struktur – d. h. der vorgegebenen Plätze – des Wassernetzwerks. Die Veränderungen der Wasserstruktur, so leiten die Forscher ab, könnten einen eigenen Beitrag zur Katalyse leisten, für die die Wasserinteraktionen eine wichtige Komponente sind. Diese Erkenntnis liefert Ansatzpunkte für weitere Arbeiten, zum Beispiel von Kolleginnen und Kollegen aus der Biotechnologie, die sich mit der Nutzung von Enzymen in technischen Anwendungen beschäftigen.
Dass das Wasser eine Rolle auf dieser langsamen, für die Katalyse wichtigen Zeitskala spielt, ist auch eine wichtige Information für die Wissenschaftlerinnen und Wissenschaftler von Resolv. Im Exzellenzcluster der TU Dortmund und der Ruhr-Universität Bochum erforschen sie, wie Lösungsmittel in die Kontrolle, Vermittlung und Steuerung chemischer Reaktionen involviert sind.
Das Team
Den Fachartikel hat Prof. Rasmus Linser gemeinsam mit seinen Mitarbeitern Dr. Himanshu Singh und Dr. Suresh Vasa veröffentlicht. Von der Ruhr-Universität Bochum waren Prof. Lars Schäfer, Dr. Christopher Päslack und Dr. Chandan Das beteiligt. Außerdem wirkten Wissenschaftler von der Ludwig-Maximilians-Universität München mit.
Über Prof. Rasmus Linser
Prof. Rasmus Linser nahm 2018 den Ruf an die TU Dortmund an. Er brachte mit der biomolekularen NMR-Spektroskopie ein neues Fachgebiet an die Fakultät für Chemie und Chemische Biologie. Linser studierte Chemie in Göttingen und Madrid. 2010 promovierte er an der Humboldt-Universität und am Leibniz-Institut für molekulare Pharmakologie in Berlin. Nach einem Jahr an der University of New South Wales (UNSW) in Sydney, Australien, verbrachte er drei Jahre abwechselnd an der Harvard Medical School in Boston, USA, der UNSW Sydney und dem Walter and Eliza Hall Institute in Melbourne, Australien. Ab 2014 war Linser Emmy-Noether-Nachwuchsgruppenleiter am Max-Planck-Institut für biophysikalische Chemie in Göttingen, 2015 wurde er auf eine Professur an der Ludwig-Maximilians-Universität München berufen.
Über RESOLV
Bund und Länder fördern das Exzellenzcluster RESOLV bereits seit 2012. Sprecherhochschulen sind die TU Dortmund und die Ruhr-Universität Bochum. Das Team besteht aus über 200 Wissenschaftlerinnen und Wissenschaftlern. Sie wollen verstehen, wie das Lösungsmittel in die Kontrolle, Vermittlung und Steuerung chemischer Reaktionen involviert ist. Schließlich finden die meisten chemischen Reaktionen, wichtige industrielle Prozesse und nahezu alle biologischen Vorgänge in flüssiger Phase statt.
Ansprechpartner für Rückfragen: